Original: http://www.tulane.edu/~wiser/protozoology/notes/api.html
У найпростіших є монофілетична група, що складається майже цілком з паразитичних (тобто відсутність вільного життя) видів. Найпростіші, поряд з інфузоріями і дінофлагеллятами, утворюють вищу групу порядку, відому як “альвеолятні”. Основною визначальною характеристикою цієї групи є згладжені везикул-подібні структури – називаються “кіркові альвеоли” – які знаходяться безпосередньо під плазматичноїмембраною. Раніше найпростіші були частиною групи під назвою споровикові, це ім’я до цих пір іноді використовується. Було кілька пропозицій, щоб повернутися до імені споровикових (Кокс, Тр. Парасітол. 18: 108).
Електронна мікроскопія показала унікальні ультраструктурні особливості між різними споровиков, які були згодом використані для перевизначення груп. Визначальною характеристикою найпростіших є група органел, знайдених на одному кінці – називається верхівковий кінець – організму. Цей «верхівковий комплекс» включає в себе секреторні органели, відомі як мікронеми і роптрії, полярні кільця, що складаються з мікротрубочок, а у деяких видів коноїд, який лежить в межах полярних кілець. У якийсь момент протягом усього їх життєвого циклу, члени Apicomplexa або вторгатися або прикріпити до клітин-господарів. Саме під час цього інвазивного (і / або мотільних) стадії, що ці органели апікальні виражені, а також subpellicular мембран, які насправді кортикальні альвеоли. Апікальні органел відіграють певну роль у взаємодії паразита з кліткою-хазяїном і подальшого вторгнення в клітини-господаря. (Див. детальне обговорення вторгнення клітини-господаря малярійного паразита.) Рухливі форми Apicomplexa повзати по субстрату в НЕ амебоидние моди, відомий як ковзаючи моторику. Багато апікомплексні види джгутикових гамет.
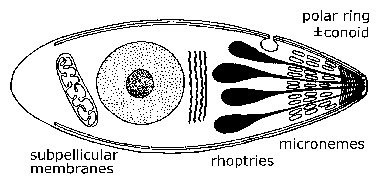
Загальна структура та життєвий цикл найпростіших. Інвазивні і/або рухомі форми найпростіших відрізняються певними ультраструктурними особливостями, які можна побачити за допомогою електронного мікроскопа. На самому апикальному кінці є кільце мікротрубочок, відомих як полярне кільце. Іноді розроблену структуру цитоскелета відомий як коноида також розглядається. Малі еліптичні везикули, відомі як мікронеми також видно на цьому кінці, а також слізні у формі крапель органели, звані роптріями.
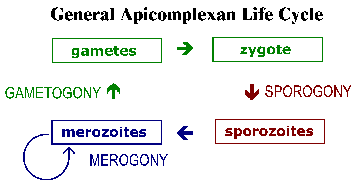
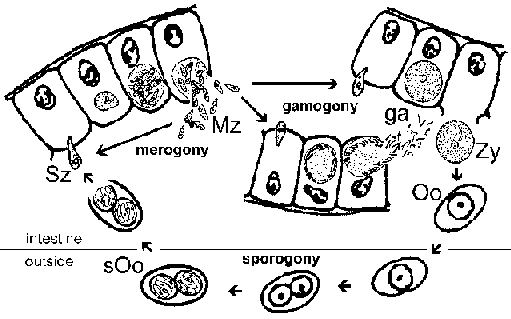
Найпростіші мають складні життєві цикли, які характеризуються трьома різними процесами: спорогония, мерогоніі і гаметогоніі (малюнок). Хоча більшість найпростіших показують це в цілому загальний життєвий цикл деталі можуть відрізнятися в залежності від виду. Крім того, термінологія, яка використовується для опису цих різних стадій життєвого циклу варіюються між видами. Життєвий цикл складається з обох безстатевим, відтворюють форм і сексуальних етапів. У моноксеничних видів усі три з цих процесів будуть здійснюватися в одному вузлі і часто в одному типі або тканини клітини. Зауважте, у гетероксеничних видів проводитимуться різні процеси в різних хостах і зазвичай включатимуть у себе різні тканини.
Спорогоніі відбувається відразу після того, як статевий фази і складається з безстатевого розмноження, який завершується у виробництві спорозоїтів. Спорозоїти инвазивная форма, яка буде вторгатися клітини і розвиватися у формах, які піддаються інший безстатеве реплікації відомий як мерогоніі. Мерогоніі і результуючі мерозоїти відомі багатьма різними назвами, в залежності від виду. На відміну від спорогоніі, в якому, як правило, тільки один раунд реплікації, досить часто існує кілька раундів мерогоніі. Іншими словами, мерозоїти, які також є інвазивні форми, можуть повторно вторгатися в клітини та ініціювати черговий раунд мерогоніі. Іноді ці кілька раундів мерогоніі включатиме перемикач в організмі-хазяїні, або перемикач в типі клітини захоплена паразита, що призводить до різних етапах мерогоніі. В якості альтернативи безстатевих мерозоїтів реплікації може розвинутися в гамети через процес називають по-різному гаметогоніі, гамогонії або гаметогенеза. Як і в інших типах статевого розмноження, гамети зливаються, утворюючи зиготу, яка буде зазнавати спорогонія.
Найпростіші є надзвичайно великою і різноманітною групою (> 5000 названих видів). Сім видів інфікувати людей (коробка). Плазмодій як збудник малярії має найбільший вплив на здоров’я людини. Бабезія є відносно рідкісною зоонозною інфекцією. Решта п’ять видів все класифікуються як кокцидий. Однак останнім часом молекулярна дані вказують на те, що криптоспоридіями тісніше пов’язана з грегарін ніж кокцидий. Кокцидий, як правило, вважаються умовно-патогенними мікроорганізмами, і часто пов’язані зі СНІДом. Кілька апікомплексні паразити також важливі з точки зору ветеринарії і сільського господарства. Найбільш примітними є бабезія і тейлерія у великої рогатої худоби і еймерія у птиці.
| Історично найпростіші були описані як група тільки з паразитичними формами. Це і їх унікальні вершинні органели виховують питання щодо походження цієї групи. Філогенетичний аналіз вказує на те, що члени або рід коподелла утворюють споріднену групу з найпростішими (1). У колподеллід хижі жгутикові, які харчуються одноклітинними водоростями за допомогою процесу, званого “мізоцитоз”. Мізоцитоз залучає хижака (або паразита) прикріплення до видобутку (або господар) і буквально висмоктує з цитоплазми клітини жертви за допомогою спеціалізованих структур. Ця програма і взаємодія з клітиною здобиччю опосередковується органел, подібних до тих, що найпростіші використовують для прикріплення до або вторгнення в клітини-господарі. Таким чином, еволюція найпростіших, ймовірно, походить від цього мізоцитоз-хижацтва до мізоцитоз-паразитизму, а виставлені грегаріни і криптоспоридії – до внутрішньоклітинних паразитів.
Інші мізоцитозні організми з найпростіших як верхівкових органел включають перкінсус, паразити устриці і мідії, і парвілюцифера, хижак дінофлагелляти. Ці перкінсиди, однак, утворюють сестринську групу з дінофлагеллати і не найпростішими (малюнок). Це говорить про те, що прабатьком дінофлагеллятних і апікомплексні скарби, можливо, був хижий жгутиконосца і що апікальні органели були збережені в апікомплексні скарби, але програв у більшості дінофлагеллятних скарби. 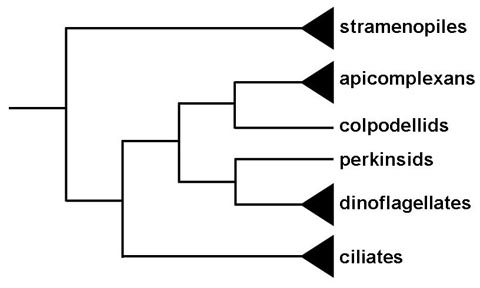 Інший зв’язок між водоростями і найпростішими – хлоропластний залишок, званий апікопласт, його можна знайти в більшості найпростіших (2). Апікопласт, швидше за все, є результатом вторинного ендосимбіозу червоної водорості і, ймовірно, тієї ж ендосимбіотичної події, що викликає пластид дінофлагеллати. Апікопласт є нефотосинтезирующих, але експонати заходи, пов’язані з біосинтезі типу II жирних кислот, біосинтезу изопреноидов, і, можливо, гема синтезу. Ці шляхи є по суті прокариотической і являють собою чудові цілі наркотиків. Фотосинтетичної пористі, хромерида велія, що, як видається, найраніше розгалуження апікомплексні також була визначена (3).
|
КОКЦИДІЇ
Кокцидії характеризуються товстостінною стадією ооцист, які, як правило, виводяться з організму з калом. Деякі кокцидії (криптоспоридії, циклоспори, ізоспорії) проводять весь свій життєвий цикл в епітеліальних клітинах кишечника господаря і передаються фекально-оральним шляхом. Інші кокцидії (саркоциста, токсоплазма) мають більш складний життєвий цикл за участю кіст тканини і декількох хостів (тобто господарів).
Криптоспоридії
Так як його первинне визначення в 1907 декілька видів криптоспоридій були визначені в найрізноманітніших тварин, починаючи від риб до людини. Перші людські випадки криптоспоридіоз було зареєстровано в 1976 році і були охарактеризовані як шлунково-кишкових захворювань, пов’язаних з імуносупресії. Спочатку вважалося, що бути рідкісним і екзотичним захворюванням. Протягом 1980-х років криптоспоридія була визнана в якості однієї з основних причин діареї у хворих на СНІД та часто призводить до смерті. Тим не менш, у даний час визнано, що криптоспоридії є частою причиною діареї у імунокомпетентних осіб і, ймовірно, був патоген людини з самого початку людства. Було визначено два види інфікувати людей: К. парвум і К. гомініс.
ЖИТТЄВИЙ ЦИКЛ
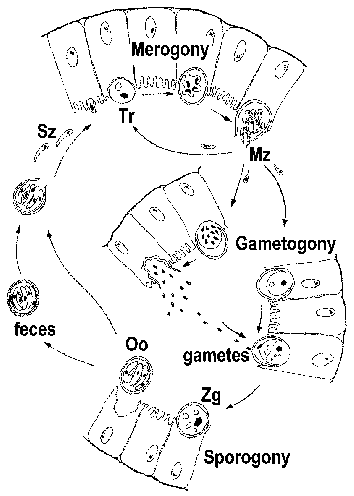 Криптоспоридії часто класифікуються як кокцидії і мають життєвий цикл, схожий на цикл інших кишкових кокцидій. Однак криптоспоридії тісніше пов’язані з грегарінами, і це знаходить своє відображення в деяких аспектах їхнього життєвого циклу. Інфекція потрапляє через рот спорулірованних ооцист (малюнок). [Див. великий малюнок життєвого циклу з докладною легендою.] Зміни рН, пов’язані з проходженням через кишечник і жовчі та підшлункової рідини в тонкій кишці тригера Ексцістірованіе. Спорозоїти (SZ) виходять з ооцисти і прикріплюються до епітеліальних клітин кишечника. На відміну від інших кокцидий, криптоспоридії спорозоїти не вторгатися в ентероцитів. Замість того, щоб вони індукують синтез і розширення мікроворсинок, що призводить до паразита стає оточене подвійною мембраною господаря походження. Зчленування, називається «фідер органели» або «прилипання зона», утворюється між паразитом і приймаючим ентероцитів. Паразит, який тепер називається трофозоіти (ТГ), ймовірно, відбувається поживні речовини з клітини-хазяїна за допомогою цього переходу. (Для огляду процесу «вторгнення» див. Боровський та ін, 2008.)
Криптоспоридії часто класифікуються як кокцидії і мають життєвий цикл, схожий на цикл інших кишкових кокцидій. Однак криптоспоридії тісніше пов’язані з грегарінами, і це знаходить своє відображення в деяких аспектах їхнього життєвого циклу. Інфекція потрапляє через рот спорулірованних ооцист (малюнок). [Див. великий малюнок життєвого циклу з докладною легендою.] Зміни рН, пов’язані з проходженням через кишечник і жовчі та підшлункової рідини в тонкій кишці тригера Ексцістірованіе. Спорозоїти (SZ) виходять з ооцисти і прикріплюються до епітеліальних клітин кишечника. На відміну від інших кокцидий, криптоспоридії спорозоїти не вторгатися в ентероцитів. Замість того, щоб вони індукують синтез і розширення мікроворсинок, що призводить до паразита стає оточене подвійною мембраною господаря походження. Зчленування, називається «фідер органели» або «прилипання зона», утворюється між паразитом і приймаючим ентероцитів. Паразит, який тепер називається трофозоіти (ТГ), ймовірно, відбувається поживні речовини з клітини-хазяїна за допомогою цього переходу. (Для огляду процесу «вторгнення» див. Боровський та ін, 2008.)
Трофозоіти проходять безстатеве реплікацію (тобто мерогоніі) і виробляють 4-8 мерозоитов (Mz), які вивільняються в просвіт кишечника. Мерозоїти заражають нові епітеліальні клітини кишечника і пройти додаткові раунди мерогоніі. Підвищена ступінь тяжкості захворювання у пацієнтів з імунодефіцитом частково пояснюється їх нездатністю обмежити ці додаткові раунди мерогоніі.
В якості альтернативи мерогоніі, мерозоїти може розвинутися в будь-який макро- або мікрогаметоцітов після зараження в ентероціте. Мікрогаметогенезе включає в себе кілька раундів реплікації з подальшим випуском численних мікрогамет в просвіт кишечника. Мікрогамет запліднити макрогамета ще прикріплені до епітеліальних клітинах кишечника. Отриманий в результаті зиготи (Зг) піддається спорогония і спорулірованних ооцист (Оо) виводяться з організму з калом. Самозараження також можливо і це теж може сприяти збільшенню ступеня тяжкості захворювання у пацієнтів з імунодефіцитом.
ПЕРЕДАЧА І МОЛЕКУЛЯРНА ЕПІДЕМІОЛОГІЯ
Фактори ризику передачі криптоспоридій подібні до інших фекально-оральних захворювань. Проте, що передаються через воду спалаху криптоспоридіоз були особливо помітні. Найбільш сумнозвісним є спалах в Мілуокі протягом весни 1993 року, у якому, за оцінками, 400000 чоловік розвинувся симптоматичний криптоспоридіоз (Маккензі та ін, Журнал медицини Нової Англії 331:161, 1994). Фактори, що сприяють зростанню ризиків спалахів криптоспоридіозу, які передаються через воду:
– невеликий розмір ооцист 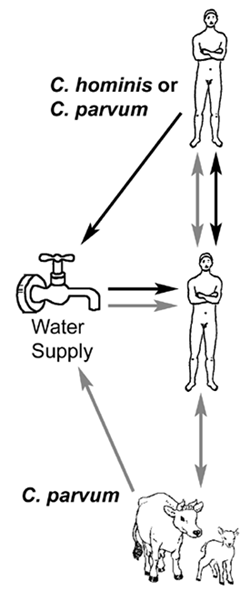
– широкий спектр приймаючої специфічності і моноксеничність розвитку
– тісні зв’язки між господарями людей і тварин
– велика кількість ооцист з організму (до 100 мільярдів на теля)
– низька інфекційна доза
– витривалі ооцисти, які стійкі до впливу хлору
– інфекційні споруліровані ооцисти з організму
Незважаючи на значимість деяких спалахів, які передаються через воду, передача вірусу від людини до людини, здається, переважають. Наприклад, безсимптомні інфікованих дітей є спільними, вторинні випадки в домашніх господарствах є високими, і спалаху, як правило, відбуваються в лікарнях, установах і центрах денного догляду за дітьми – ситуацій, характерних для фекально-оральної передачі. Молекулярні дослідження показали два основних генотипів, виділених у людини. Генотип 1 тільки був виділений з людських джерел і є неінфекційний для мишей і телят. Генотип 2 було виділено з обох тварин (великої рогатої худоби і овець) і людини, і є інфекційний для мишей і телят. На підставі цих та інших біологічних відмінностей було запропоновано перейменувати генотип 1 як криптоспоридія гомініс (Морган-Райан та ін., Журнал еукаріотичної мікробіології 49:433, 2002). Інші види та генотипи криптоспоридію були ізольовані від хворих на СНІД та нерідко з імунокомпетентних людей (Морган та ін., Журнал клінічної мікробіології 38:1180, 2000) (наприклад, К. фелі, собачий генотип, і т.д.). Третій вид з індійського субконтиненту, К. віаторум, також було запропоновано (Елвін та ін., Міжнародний журнал паразитології 42:675, 2012).
Генетичні дані свідчать про те, що існують два різних циклів передачі в організмі людини за участю двох різних популяцій криптоспорідіумом: 1) виключно антропонозной (тобто від людини до людини) циклу, викликаного генотипом 1 (або К. гомініс) і 2) зоонозних цикл викликані генотипу 2 (або К. парвум). Зоонозних цикл буде спочатку включати в себе передачу від тварин (наприклад, велика рогата худоба і вівці) для людини, а потім згодом від людини до людини передачі і, можливо, передачі вірусу від людини до тварини. Обидва генотипи були продемонстровані бути етіологічним агентом в осередках передачі у воді. спалаху переносяться водою, пов’язані з К. гомініс, ймовірно, через забруднення води з людської каналізації, в той час як водні спалахи, пов’язані з К. парвум (генотип 2), імовірно, через забруднення води калом корови чи вівці.
ПАТОГЕНЕЗ
Найбільш поширеним клінічним проявом криптоспоридіозу є легка або рясна водяниста діарея. Ця діарея, як правило, самообмеження і зберігається від декількох днів до одного місяця. Recrudescences є загальними. Біль у животі, анорексія, нудота, втрата ваги і блювота є додаткові прояви, які можуть виникнути під час гострої стадії. Захворювання може бути набагато серйознішими для осіб, хворих на СНІД, яка проявляється як хронічна діарея триває протягом декількох місяців або навіть років. Деякі хворі на СНІД демонструють блискавичний холерою, як хвороба, яка вимагає внутрішньовенного регідратації. Летальність може бути досить високим в цих випадках Блискавичний.
Діарея може мати осмотичний, запальні, або секреторних компонентів (вставка). Рідкий характер діареї, пов’язаної з інфекцією криптоспоридію запропонував наявність ентеротоксину. Тим не менше, немає ніяких доказів для токсин-опосередкованої секреторною діареї, незважаючи на зусилля по виявленню такого токсину. Експериментальні дані показують, що робить глюкозу в поєднанні Na+, поглинання зменшується і Cl- секреція збільшується. Таким чином, діарея, пов’язана з криптоспоридієм, як видається, в першу чергу осмотичний в природі (див малюнок). Пов’язаний з цим порушенням ентероціте (тобто епітеліальні клітини кишечника) функція є притуплення клітинної гіперплазії ворсинок і крипт. Можливий механізм патогенезу є те, що інфекція епітеліальних клітин кишечника із криптоспоридієм пошкодження ентероцитів і в кінцевому підсумку призводить до їх загибелі. Це викликає поділ клітин в області крипт (тобто гіперплазія), щоб замінити пошкоджені клітини. Поєднання руйнування absorbtive клітин на кінчиках ворсинок і збільшення Cl – секретуючі крипту призводить до загального підвищення секреції.
| Характеристика діареї |
|---|
осмотична
запальна
секреторна
|
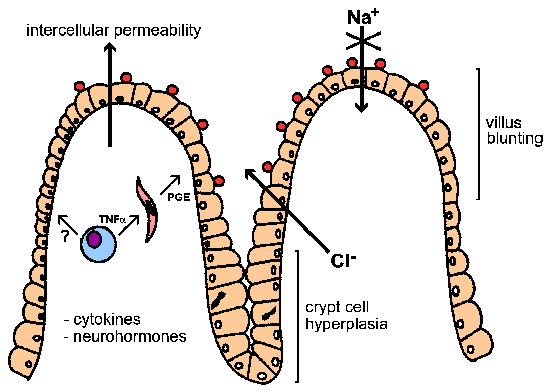
Схематичне уявлення патогенезу криптоспоридію. Багато факторів можуть бути залучені в діареї, пов’язаної з криптоспоридіозом. (Змінено на основі Кларка і Сірз Паразитологія сьогодні 12:221, 1996).
Окрім того, підвищена проникність і міжклітинний запалення в підслизовому шарі (він же, власна пластинка слизової оболонки) був пов’язаний з інфекцією криптоспоридію. Це явище може також сприяти секреторному процесу за допомогою цитокінів і нейрогормонів. Наприклад, макрофаги, секретирующие фактор некрозу пухлини альфа (TNF-a) або інші цитокіни можуть стимулювати фібробласти і інші клітини у власній пластинці слизової оболонки секретують простагландинів (PGE) та інші продукти (наприклад, реактивні інтермедіати кисню). Ці продукти можуть потім сприяти секреції і погіршують всмоктування.
Паразит проявляє трофику для худої і клубової у імунокомпетентних осіб, в той час як інфекція більш широко поширена у хворих на СНІД та може включати в себе шлунка, дванадцятипалої кишки, товстої кишки і жовчних шляхів. Це більш великий діапазон анатомічне у хворих на СНІД, імовірно, через нездатність імунної системи контролювати і обмежувати інфекцію. Клітинний імунітет мабуть, основним компонентом імунної відповіді на усунення інфекції, про що свідчить кореляція між нижчим CD4 + Т-клітин, а також ризик і тяжкість криптоспоридіоз. Інтерферон-гамма, інтерлейкін-12, і фактор некрозу пухлини-альфа беруть участь в захисті від інфекції криптоспоридію.
ДОДАТКОВІ ПОСИЛАННЯ
- Кларк Д.П., Сірз К.Л. (1996) Патогенез криптоспоридіозу. Паразитологія сьогодні 12:221
- Геррант Р.Л. (1997) Криптоспоридіоз: дуже заразна загроза, яка з’являється. Інф. захв., які з’являються 3:51
- Грег Ханнас. Криптоспоридій парвум: патоген, який з’являється. http://biology.kenyon.edu/slonc/bio38/hannahs/crypto.htm
- Н.Е. Рамірес, Л. Уорд і С. Сріватсан (2004) Огляд біології та епідеміології криптоспоридіоз у людей і тварин. Мікроби і інфекції 6, 773-785.
- Роуз Дж.Б., Хаффман Д.Е., Дженнакарро А. (2002) Ризик і контроль криптоспоридіозу, що передається через воду. Огляди мікробіології FEMS 26:113.
- Саннотель О. та ін. (2006) Криптоспоридій. Записи у прикладній мікробіології 43, 7-16.
- Ксяо Л. і Райан Ю.М. (2004) Криптоспоридіоз: оновлення в молекулярній епідеміології. Поточні думки в інфекційному захворюванні 17, 483-490.
- Ксяо Л. і Фенг Я. (2008). Зоонозний криптоспоридіоз. Імунологія та медична мікробіологія FEMS 52: 309-323.
Ізоспора
Ізоспора беллі, як вважають, є дійсним видом, який заражає тільки людей. Він має поширення в усьому світі, але частіше зустрічається в тропічних районах і районах з поганими санітарними умовами. Інфекції часто протікають безсимптомно, і ті, з симптомами, як правило, саме обмеження тривалістю кілька тижнів. Інфекції є більш поширеними і симптоми більш серйозними у хворих на СНІД, що у імунокомпетентних осіб.
Життєвий цикл. Інфекція купується через рот спорулірованних ооцист (СОО). Спорозоїти (SZ) є вивільнення в просвіт кишечника і вторгнутися в епітеліальні клітини кишечника. В епітеліальних клітинах паразита проходить виток мерогоніі, що веде до виробництва мерозоитов (Mz). Звільнені мерозоїти повторно вторгаються в епітеліальні клітини кишечника і можуть пройти додаткові раунди мерогоніі або розвинутися в будь-який мікро- або макрогамонт. Мікрогамет (GA) буде запліднити макрогамета (GA) з утворенням зиготи (ZY), який переростає в ооцисти (Оо). Незрілі ооцисти передаються в калі і дозрівання в інфекційних спорулірованних ооцист відбувається в навколишньому середовищі. Впізнавані етапів протягом цього дозрівання (тобто спорогония) включають ооцист з одного споробласту, ооцисти з двома споробластами і витримане ооцистами з двома спороцисту, кожен з яких містить чотири спорозоїти. [Див. також докладне обговорення “Життєвий цикл криптоспоридію“.]
Симптоми та патогенез. Симптоми, пов’язані з інфекцією І. беллі, включають пронос, стеаторею, головний біль, лихоманку, біль у животі, нудоту, зневоднення і втрату ваги. Кров рідко присутня в калі. Загалом, симптоми аналогічні до криптоспоридіозу. Захворювання часто самообмежуюче. Проте, може стати хронічним, з ооцисти виявляються в калі протягом декількох місяців до декількох років і симптомів повторного захворювання. Захворювання має тенденцію бути більш серйозними у немовлят і маленьких дітей, ніж у дорослих. Патології, пов’язані з інфекцією І. беллі, в першу чергу атрофія ворсинок, або притуплення і гіперплазію крипт, як зазвичай бачили в інших кишкових інфекціях.
Діарея у хворих на СНІД часто дуже водянистий і може призвести до зневоднення організму, що вимагають госпіталізації. Лихоманка і втрата ваги також часта знахідка. Інший поширений висновок серед хворих на СНІД є хронічним переривчастий діарея триває протягом декількох місяців до декількох років. Отриманий в результаті надмірної втрати ваги і електролітний дисбаланс може призвести до гіпотрофії і навіть смерті. Там були також декілька повідомлень про поширюваної позакишкового изоспороз у хворих на СНІД.
Ліндсей Д.С., Дубей Дж.П., Блегберн Б.Л. (1997) Біологія видів ізоспори від людей, приматів і домашніх тварин. Огляди клінічної мікробіології, 10: 19-34.
Циклоспора
Перші людські випадки циклоспора каєтаненсіс було зареєстровано в 1979 р Він був спочатку згадується як ціанобактерій-подібних тіл або кокцидий типу тіл (CLB). Організм був підтверджений бути кокцидій паразитує зі структурою ооцист подібно роду циклоспора, а потім їм в 1994 році після Перуанського університету Каетано Ередіа в Перу, де більшість ранніх досліджень було виконано. Молекулярні дослідження вказують на тісний зв’язок з Егтепа, що є важливим ветеринарного паразита птиці та інших домашніх тварин. Ц. каєтаненсіс має поширення в усьому світі, але мабуть, особливо поширена в Латинській Америці, на Індійському субконтиненті і в Південно-Східній Азії. У розвинених країнах інфекції, як правило, пов’язані якого харчового походження спалахів або діареї мандрівників.
Життєвий цикл і передача. Життєвий цикл циклоспори схожий на ізоспору (див. вище). Інфекція потрапляє через рот ооцист. Спорозоіти вивільняються й інфікують епітеліальні клітини верхніх відділів тонкої кишки. Паразит піддається мерогоніі і мерозоїти ентероцитів і повторно заразити ще кілька раундів мерогоніі може статися. Деякі з мерозоитов проходять статевий розвиток, що приводить до виробництва мікро- і макрогамета. Запліднення макрогамети по мікрогамети ініціює спорогоніі і освіту ооцисти. Як ізоспора споруляції завершується в навколишньому середовищі і незрілих неінфекційні ооцисти виділяються з фекаліями. Дозрівання ооцист до спорулірованних інфекційних ооцист, ймовірно, потрібно кілька днів до кількох тижнів. Крім того, структура ооцист циклоспори відрізняється від такого виду ізоспори. Ооцист містить два спороцисти кожна з яких містить два спорозоїтів.
Кілька спалахів в Сполучених Штатах і Канаді були пов’язані зі свіжими продуктами, що імпортуються з Південної і Центральної Америки (таблиця). Зокрема, ягоди і листові овочі були ідентифіковані як вірогідний забрудненого елемента. Це продукти харчування, які, як правило, їдять в сирому вигляді і тільки промиті. Немає спалахів не були пов’язані з замороженими, обробляються або очищені фрукти або овочі. Сезонність в осередку також спостерігається при більшості випадків відбувається навесні і на початку літа. Подібна сезонність спостерігається в ендемічних країнах також. На відміну від Сполучених Штатів і Канади, де домінує передача харчового походження, більшість випадків в Європі і Австралії були пов’язані з поїздками в ендемічні країни.
Вибрані випадки спалаху циклоспоріозу У Сполучених Штатах і Канаді |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Змінено на основі Хервальдта (2000) й оновлено. Знаки питання (?) вказують на можливі, але не остаточні дані про носія або походження. |
У результаті великого числа спалахів захворювань, пов’язаних з малиною, із Гватемали Сполучені Штати обмежили імпорт малина і потрібно огляд ферм. Це призводило до подальшого зниження кількості спалахів в Сполучених Штатах. Канада, яка не обмежує завезення, не відчували зниження числа спалахів протягом цього періоду. Наступні тематичні контрольовані дослідження, проведені в Гватемалі показали, що інфекції були найбільш часто зустрічається у дітей з переважанням загостренням в червні. Основним фактором ризику, пов’язаного з інфекцією пив неочищену воду. У Перу контакт з грунтом був ідентифікований як ще один фактор ризику, особливо серед дітей менше двох років. Недостатнє очищення води в цих ендемічних країнах може призвести до забруднення ґрунтових вод і, таким чином, підтримувати цикл передачі. Імовірно передача харчового походження через зрошення або внесення добрив із забрудненою водою або прання та обробки харчових продуктів з погано обробленої води.
Симптоми. Циклоспора головним чином інфікує епітеліальні клітини у верхній частині тонкої кишки. Інкубаційний період, як правило, одна-два тижні. Симптоми схожі на гастроентериту, викликаного ізоспорою та криптоспоридіозом, які, як правило, включають цикли водянистої діареї і періоди явної ремісії. Діарея характеризується частими табуретки і може зберігатися до шести тижнів, але, як правило, самообмеження в immunocompent осіб. Анорексія, нездужання, нудота і спазми і інші часті симптоми, пов’язані з cyclosporiasis. У деяких випадках пацієнти можуть відчувати блювота, м’язові болі, значну втрату ваги, і вибуховою пронос. Попереднє вплив ціклоспора мабуть, дає деяку стійкість до інфекції зі зменшенням симптомів. Згодом дорослі з’являються розвивати імунітет і безсимптомних носіїв можна знайти в ендемічних районах.
Як же йде справа кріптоспорідіумом і ізоспорою, діареї, викликаної циклоспорою у хворих на СНІД набагато серйознішими, ніж у імунокомпетентних осіб. Діарея може тривати протягом декількох місяців і провести синдром, який виснажливих і небезпечними для життя.
Огляди циклоспори:
Стерлінг і Ортега (1999) Циклоспора: загадка, варта розгадки. Інфекційні захворювання, які з’являються 5:48.
Б.Л. Хервальдт (2000) Циклоспора каєтаненсіс: огляд із фокусуванням на спалахах циклоспоріозу в 1990-і роки. Клінічні інфекційні захворювання 31:1040.
Дж.М. Шилдс і Б.Х. Олсон (2003) Циклоспора каєтаненсіс: огляд несформованого паразитного кокцидію. Міжнародний журнал із паразитології 33, 371-391.
Л.С. Менсфілд і А.А. Гайадхар (2004) Циклоспора каєтаненсіс, паразит кокцидію, який зароджується у їжі та воді. Ветеринарна паразитологія 126: 73-90.
Я.Р. Ортега і Р. Санчес (2010) Циклоспора каєтаненсіс, паразит, який зароджується у їжі та воді. Огляди клінічної мікробіології 23:218-234.
Діагностика та лікування кишкових кокцидій
Кокцидіоз діагностується шляхом демонстрації ооцист у фекаліях. Некислотостійке фарбування є найкращим методом для кокцидий який барвник яскраво-червоний. Криптоспоридій, циклоспора і ізоспора відрізняються за розміром і структурою ооцист (таблиця). Циклоспора й ізоспора нерівномірно займають плями, що призводить до суміші нефарбованих, частково пофарбованими і повністю пофарбованими ооцист. Циклоспора й ізоспора також можуть бути виявлені за допомогою флюоресценції, пов’язаний з кістозної стінки. Через свого щодо великого розміру, ізоспора легко виявляється в нефарбованих зразках. Саркоцистоз є рідкісною людиною інфекція (див. нижче) з ооцист, схожими на ізоспору за винятком того, що спороцисти, як правило, звільняються від ооцист в той же час у просвіт кишечника.
| Паразити кокцидію, знайдені в людських екскрементах |
||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Рекомендованим лікуванням циклоспори й ізоспори є поєднання триметоприм-сульфаметоксазол (Бактрим). Там не цілком задовільним для лікування криптоспоридію. Він висунув гіпотезу про те, що “позаклітинне” розташування криптоспоридію притулках його від наркотиків. Паромоміцин був використаний для лікування криптоспоридіоз, проте його ефективність обговорюється. Контрольовані дослідження вказують на те, що Паромоміцин скромно пригнічує паразітеміі у ослаблених осіб. Лікування важкої криптоспоридіоз повинна включати в себе підтримуючу терапію (регідратація і живильну підтримку) і анти-перистальтику агентів. Профілактичні заходи будуть аналогічні інших захворювань, що передаються фекально-оральним шляхом (див. фактори ризику або контроль гіардій).
Тканинні цисти, що утворюють кокцидії
Деякі види кокцидий демонструють heteroxenous життєвий цикл, в якому мерогоніі відбувається в тканинах проміжного господаря (видобутку) і гаметогоніі відбувається в епітелії кишечника остаточного господаря (хижак). [Відповідно до угоди, статеве розмноження відбувається в остаточних господарів.] Що стосується інфекцій людини, токсоплазма є спільною цистою тканини формування кокцидий паразита, в той час як інфекції з видами саркоцистозу досить рідкісні.
Життєвий цикл (див. малюнок) саркоцистозу всередині хижака (тобто хижого) схожий на життєві цикли кишкових кокцидий, таких як ізоспора, пов’язаних зі статевою цикл (гаметогоніі) всередині епітеліальних клітинах кишечника. Одне з відмінностей в життєвому циклі саркоцистозу є відсутність мерогоніі в епітеліальних клітинах кишечника. Іншими словами, мерозоїти, придбані ковтання інфікованої видобуток буде виробляти тільки гамети після вторгнення в епітеліальні клітини кишечника. Злиття статевих клітин призводить до виробництва ооцист. Крім того, Спороцисти, як правило, звільнені від ооцист в кишечнику господаря і тому інфекційні Спороцисти виявляються в калі.
Проміжними господарями (травоїдні) набувають інфекцію ковтаючи спорообразованія спороцисти. Спорозоїти вивільняються, вторгнутися епітеліальні клітини кишечника і піддаються мерогоніі як це характерно для кишкових кокцидий. На відміну від кишкових кокцидий мерозоїти будуть вторгатися ендотеліальні клітини і виробляють системну інфекцію. Досить часто виникає тропізм для певних тканин, таких як мозок або м’язи. У меронт (або шизонт) у цих тканинах часто инкапсулюються і називаються «тканинними кістками». Ці цисти тканини або sarcocysts в разі м’язи, часто демонструють нижчий рівень реплікації під час мерогоніі і кілька бездіяльним. Вживання в їжу зараженої тварини хижого випустить мерозоїти, які будуть вторгатися кишкові епітеліальні клітини і, таким чином, завершуючи життєвий цикл.
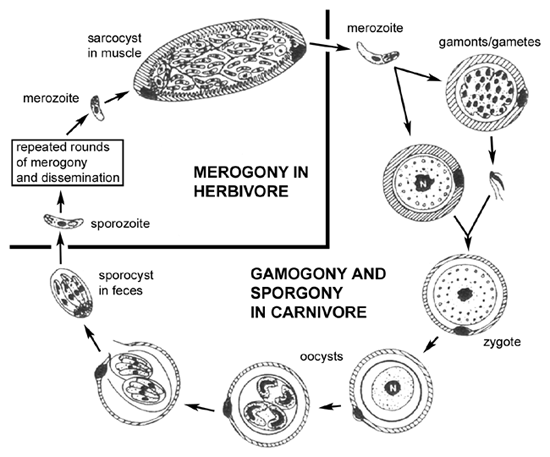
Цей життєвий цикл хижака-жертви не був розроблений до 1970-х років. Раніше кишкові інфекції у хижака, як правило, позначали як вид ізоспори й інфекції тканини в жертву, як правило, позначається як виду саркоцистоз. У багатьох випадках остаточними господарями були ідентифіковані і систематика багатьох видів саркоцистозу є невизначеним.
Інфекції саркоцистозу в людей були зареєстровані, але зустрічаються рідко. Люди є остаточним господарем для С. гомініз (також відомий як С. бовігомініз) і С. суігомініз, як визначається, джерелом інфекції є або яловичина або свинина відповідно. Вживання в їжу приготовлену яловичини або свинини із заражених тварин буде виробляти кишкову інфекцію, яка може виробляти гострі кишкові симптоми (дискомфорт в животі, нудота, діарея). Проте, більшість інфекцій, як вважають, протікає безсимптомно. Заражені люди можуть пролити спороцисти в калі протягом декількох тижнів до декількох місяців після зараження. Спороцисту з людських екскрементів ін’єкційних для корів, свиней та оленів.
Люди можуть також служити в якості проміжного господаря принаймні, деякі з видів саркоцистозу, що зустрічаються в природі. Прийом всередину спороцисти людьми може привести до стадії тканин інфекції і утворення саркоцист. Ці саркоцисти є загалом кілька сот мкм і можуть викликати невелике ушкодження тканин. Клінічні симптоми можуть включати в м’язової хворобливості або епізодичні хворобливі запальні припухлості. Ці м’язи кіст у людей були тільки спорадично повідомлялося (<100 зареєстрованих випадків) і, ймовірно, являють собою випадкові інфекції. В одному дослідженні відзначено, що саркоцисти у людей, як правило, схожі на види саркоцист, що зазвичай зустрічаються в місцевих мавп (Бівер та інші. Американський журнал тропічної медицини та гігієни 28:819, 1979). Більшість випадків були зареєстровані в тропічних і субтропічних Азії, в тому числі спалаху м’язового саркоцистозу серед мандрівників, які повертаються з Малайзії (Щотижнева статистика захворюваності та смертності 61:37).
Фаєр Р. (2004) Види саркоцистозу в інфекціях людини. Огляди клінічної мікробіології 17: 894-902.
ТОКСОПЛАЗМОЗ
Токсоплазма є кокцидий паразит, який заражає людей, а також велика різноманітність ссавців і птахів. Він володіє хижак-жертва тип життєвого циклу (як описано вище для саркоцистозу) і котячих є єдиним остаточним господарем. Токсоплазмоз зустрічається по всьому світу (за винятком дуже холодних або сухому кліматі) і має тенденцію бути більш поширені в тропічному кліматі. Серологічні дослідження показали рівень поширеності ВІЛ до 70% у віці до 25 років в деяких центральних американських популяціях. У Сполучених Штатах, за оцінками, 0,5-1% населення заражається щороку і поширеність коливається від 10-25% у віці до 25 років токсоплазмоз найчастіше є доброякісним захворюванням. Зазначені виключення у випадках вродженої інфекції або індивідуумів з ослабленим імунітетом.
- Життєвий цикл
– Передача людиною
– Нещодавнє розширення токсоплазми - Клінічні особливості
– Вроджений
– Окулярний - Діагностика, лікування та профілактика
Життєвий цикл
Токсоплазма має складний життєвий цикл, що складається з кишечника і тканинних фаз. Незважаючи на те, що організм був вперше виявлений в 1908 році в якості тканини паразит гонді (африканський гризунами), його повний життєвий цикл не був визначений до 1970 року Кишкова фаза інфекції не відбувається тільки в котячих і демонструє типову кишкову кокцидій життєвий цикл, що складається з мерогоніі і гамогонії (див. життєвий цикл ізоспори). Кішки набувають інфекцію при вживанні в їжу тварин, інфікованих стадії тканини паразита. Паразити вторгаються епітеліальні клітини кишечника і піддаються мерогоніі. Отримані в результаті мерозоїти може або пройти додаткові раунди мерогоніі або пройти гаметогоніі. Як схожий на інші найпростіші (див. загальний життєвий цикл найпростіших) макро- і мікрогамети виробляються. Таким чином, кішка вважається остаточним господарем, так як це господар, в якому відбувається статевий цикл.
Бі-джгутикових мікрогамети вивільняються в просвіт кишечника і запліднити макрогамета в приймаючому епітеліальних клітинах. Секреція ооцист стіни починається незабаром після запліднення. Цей статевий цикл завершується у виробництві ооцисти, які виділяються в фекаліях. Ці незрілі ооцисти піддаються спорогоніі при температурі навколишнього середовища в результаті зрілих ооцист, що містять два спороцисти, кожен з чотирма спорозоїтів. Спороношение зазвичай займає 1-4 днів і ооцисти залишаються інфекційний протягом декількох місяців в затіненому вологий грунт. Було висловлено припущення, що незапліднених макрогамета також можуть бути здатні до утворення зрілих ооцист (Фергюсон, Тренди в паразитології. 18:351, 2002). 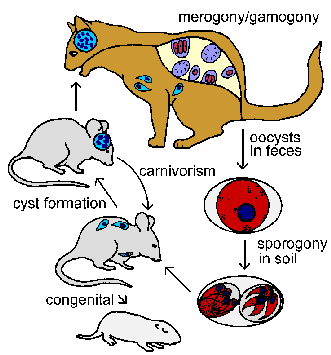
Проміжні господарі, такі як гризуни і птиці, заражаються через рот спорулірованних ооцист. Спорозоїти вивільняються, проникають в кишковий епітелій, і вторгнутися в макрофаги та інші типи клітин. Процес вторгнення є типовим для найпростіших, і паразит знаходиться в межах паразітофорной вакуолі. У вакуолі паразит піддається бінарна розподіл (тобто мерогоніі) за допомогою унікального процесу, званого ендодіогенія. Ендодіогенія є спеціалізованим типом поділу, в якому дві дочірні клітини утворюються всередині материнської клітини. Ці трофічні форми називаються тахізоітами (тахі означає швидке) по відношенню до їх високого рівня реплікації. Клітка-господар буде розриватися і звільнити тахізоіти, які будуть вторгатися в нові клітини-господарі і повторити цикл репликативної. Інфіковані макрофаги поширюватиме тахізоіти в ополченні під час цієї гострої інфекції.
У міру того як господар виробляє імунітет швидкість реплікації буде повільним і інфіковані клітини-господарі стануть герметичні (тобто кіст тканини). Ці повільно відтворюються форми називаються брадизоітами (бради означає повільний) і являють собою бездіяльний або стану спокою. Брадизоіти вважаються метаболічно в стані спокою, але залишаються життєздатними (Дубі й інші. Огляди клінічної мікробіології 11:267, 1998). Інші зміни, які відбуваються, коли тахізоіти перетворити в брадизоіти включають секрецію хітину і інших компонентів з утворенням кіст стінки і накопичення амілопектину гранул (відображають зберігання глюкози). Кісти тканини токсоплазми демонструють різноманітність розмірів, але часто отримують розмір 50-70 мкм в діаметрі, що містить 1000-2000 брадизоітів. Брадизоіти в основному знаходяться в мозку і м’язовій тканині, у той час як тахізоіти, як правило, в ретикуло-ендотеліальних клітинах.
Стан брадизоітів є хронічною інфекцією і, ймовірно, зберігається протягом життя господаря. Механізм цього наполегливості невідома. Деякі дослідники вважають, що цисти тканини періодично ламаються і звільнити брадизоітів, які будуть вторгатися в нові клітини господаря і призводять до утворення більшої кількості кіст тканини.
Фаза тканини інфекції можуть також передаватися врожденно до потомству і іншим проміжних господарів через хижацтво. Вживання в їжу зараженої тварини випустить брадизоіти з цист тканини, які потім інфікують клітини в нового господаря. Можливо, у всіх ссавців, включаючи людину, можуть заразитися токсоплазмозом. Як і в разі придбання інфекції через прийом їжі ооцист, паразити будуть проходити через гостру фазу характеризується швидким тиражування з подальшою хронічній фазі характеризується кіст покояться тканин. Вживання в їжу зараженого проміжного господаря кішкою ініціюватиме кишечника стадію життєвого циклу за участю мерогоніі і гамогонії в кишкових епітеліальних клітинах. Кішки можуть також підтримувати стадію тканин інфекції.
| Передача людиною |
|---|
|
Очевидно, що люди не є природною частиною життєвого циклу “хижак-жертва” і являють собою випадковий вузол, який не бере участі в продовженні циклу передачі. Одним з джерел інфекції є прийом всередину матеріалу, забрудненого спорулірованних ооцист виводиться з організму кішки. Це має на увазі деяку асоціацію з кішками. Проте, так як ооцисти повинні дозрівати в навколишньому середовищі, перш ніж стати заразним, передача буде включати в себе функції передачі грунту аналогічно до ізоспори і циклоспори. Наприклад, діти повзати і брудну їжі віку, як вважають, схильні до вищого ризику зараження. Ооцисти також можуть бути придбані через садівництва діяльності або немитих фруктів або овочів. Крім того кілька водорозчинні спалаху були зареєстровані. Висока поширеність токсоплазмозу в Південній і Центральній Америці, як вважають, через високі рівнів забруднення навколишнього середовища з ооцист. Як не дивно, контакт з собаками більше фактор ризику для зараження токсоплазмозом, ніж контакт з кішками. Це, ймовірно, через собаку пошуком кішки фекалії і стають забрудненими з фекаліями, а потім передачі спорулірованних ооцист на одяг і руки їх власників. Цікаво відзначити, що водорозчинний спалах, пов’язаний із кошенятами, які живуть на вершині муніципального резервуара води в Бразилії було повідомлено (де Моура й інші, 2006. Інфекційні захворювання, які з’являються 12:326).
Токсоплазмоз також може потрапити через прийом їжі у вигляді недовареного м’яса, що містить цисти тканини або тахізоіти. Імовірно худоби набувають інфекцію через пасовища в районах, забруднених котячими фекаліями. Здатність паразита передавати між проміжними господарями можуть бути порівняно недавно еволюційна адаптація паразита, що збігається з одомашненням кішки і розширенням сільського господарства (див. вставку). Насправді, більшість інфекцій у Сполучених Штатах і Європі серед дорослих, ймовірно, отримані з недовареного м’яса. Особливо висока серопозитивна ставка у Франції (до 90%), імовірно, це пов’язано з культурною пристрастю до злегка вареного або сирого м’яса. Баранина і свинина є більш поширеними джерелами, ніж яловичина. Там були також декілька окремих повідомлень про токсоплазму, що передається через тахізоіти в непастеризованому козиному молоці.
Токсоплазмоз також може передаватися від матері до плоду, часто із згубними наслідками (див. нижче). Вроджена передача може мати місце лише під час гострої інфекції (тобто тахізоіти), придбаного в ході вагітності. Матері з хронічної інфекції, придбані до вагітності не в ризику для передачі токсоплазмозу. Передача токсоплазми в результаті пересадки органів також можлива. Тканинні цисти з хронічно інфікованого донора може активувати, коли пересаджують в раніше неінфікованих органу реципієнта. Крім того, імуносупресивної терапії може також реактивації латентної інфекції у реципієнта. Придбання тахізоітамі з гостро зараженої людини через переливання крові також можливо. Хоча, передача через трансплантацію або переливання крові в даний час відбувається рідко.
| Недавнє поширення токсоплазмозу? |
|---|
Молекулярно-генетичний аналіз ізолятів токсоплазми (в першу чергу з країн Північної Америки та Європи) показують обмежене генетичну різноманітність. Більшість (> 94%) ізолятів кластер на три різних клонових ліній, позначених як тип I, тип II і тип III. Ці три клонових родоводи тісно пов’язані між собою і складаються з різних сумішей всього двох алелей на локусів. Ці три типи можуть виникнути з генетичної рекомбінації, що відбуваються протягом останніх 10000 років (1). Це буде відбуватися одночасно з розширенням людського сільського господарства та адаптації домашньої кішки. Таким чином, зміни в поведінці людини, можливо, призвели до виділення і швидкому поширенню токсоплазми. Крім того, ці клонових типи все мають здатність передаватися через прямий пероральному між проміжними господарями, які, можливо, не є біологічною особливістю спадкового токсоплазми або інших близьких видів, як неоспора (див. вставку нижче). Це придбання прямого перорального інфекційності в поєднанні з приручення тварин може сприяти швидкому, і в першу чергу безстатеве, розширення токсоплазми.Три генотипи токсоплазми також демонструють відмінності у вірулентності (2). Наприклад, I паразити типу є високою вірулентністю у мишей. Точно так же, тип I непропорційно пов’язана з важкою атипової очного токсоплазмозу у імунокомпетентних осіб і важкої вродженої токсоплазмозу. На щастя, хоча, інфекції типу II мають тенденцію домінувати, особливо в США, проте, є деякі свідчення того, що Toxoplasma проявляє більшу різноманітність в Південній Америці. Покращення в наших знаннях про токсоплазму біології населення може допомогти вирішити ці проблеми і привести до кращого контролю і лікування.
|
 |
 |
 |
 |
Клінічні особливості
Токсоплазмоз у дорослих і дітей, які пройшли неонатальний стадії, зазвичай, доброякісні і безсимптомно. Придбання інфекції або через ооцист або тканинних кіст призводить до гострої інфекції, в яких тахізоіти які поширюються по всьому тілу через лімфатичну і hematogenously. Ця гостра стадія буде зберігатися протягом декількох тижнів, як розвивається імунітет. Антитіло виробництво вимагає 1-2 тижнів і клітинний імунітет виникає через 2-4 тижні після заражения. Обидва гуморального і клітинного імунітету, мають важливе значення, але клітинний відповідь з’являється вирішальне значення для переходу від гострої (тобто тахізоіти) до хронічних (тобто брадизоіти) інфекції. (Див. життєвий цикл, щоб отримати пояснення тахи- і брадизоітів.) Зокрема, сильну відповідь Th1, характеризуються продукцією протизапальних цитокінів, включаючи інтерлейкін-12, інтерферон-гамма і фактора некрозу пухлини-альфа пов’язані з інфекцією токсоплазми.
Коли симптоми відбуваються вони, як правило, м’який і, як правило, описується як мононуклеозоподібний з озноб, лихоманка, головний біль, болі в м’язах, втома і набрякання лімфатичних вузлів. Ці симптоми є самообмеження і вирішити протягом декількох тижнів до декількох місяців. Хронічна лімфоденопатія без лихоманки зберігаються або використовуються на термін до одного року також було відзначено як симптом токсоплазмозу. Рідко імунокомпетентних осіб виявляють серйозні симптоми і гостра інфекція майже завжди прогресує до хронічної стадії. Ця прихована інфекція, ймовірно, зберігається протягом життя пацієнта, не проводячи ніякої прогресивної патології.
Токсоплазмоз вже давно відзначено, як умовно-патогенної інфекції щодо реактивації латентних інфекцій, викликаних імуносупресії, пов’язаної з трансплантації органів і деяких методів лікування раку. Під час токсоплазмового енцефаліту 1980-х років виникла як загальне ускладнення, пов’язаної зі СНІДом. За оцінками, 25-50% хворих на СНІД з хронічним токсоплазмозом буде розвиватися енцефаліт. Реактивації інфекції зазвичай відбувається, коли число лімфоцитів CD4 впаде нижче 100 клітин на мікролітр. Ранні симптоми токсоплазмового енцефаліту можуть включати в себе головний біль, підвищення температури тіла, млявість і зміни психічного стану з прогресуванням осередкової симптоматики і конвульсії. Захворювання майже завжди пов’язане з реактивації латентної інфекції (вставка) і має тенденцію залишатися обмежується ЦНС. Іншими словами, цисти тканинні розривання і звільнені брадизоіти трансформують в тахізоітамі. (Див. життєвий цикл, щоб отримати пояснення тахи- і брадизоітів.) Координаційні пошкодження викликані руйнуванням клітин-господарів, в безпосередній близькості від нього. Інші форми реактивований захворювання, особливо ретинохороідит, пневмонія, міокардит та міозит, іноді можуть виникати в поєднанні з імуносупресією.
Карлос С. Субаусте. Токсоплазмоз і СНІД.
Вроджений токсоплазмоз
| Наслідки вродженої інфекції | ||||||||
|---|---|---|---|---|---|---|---|---|
|
Токсоплазма також може передаватися вродженим шляхом (тобто трансплацентарно), якщо мати отримує інфекцію під час вагітності. Вроджені (тобто трансплацентарні) інфекції, більш імовірно, ніж бути симптомом післяпологових інфекцій і може бути особливо серйозними (див. вставку “Підсумки”). Деякі з основних особливостей:
- передача можлива лише під час гострої стадії (тобто первинна інфекція повинна відбутися під час вагітності)
– може мати місце тільки один раз
– одна третина матерів, серологічна специфіка яких змінюється під час вагітності, передає інфекцію плоду - захворюваність від 1 на 1000 до 1 на 10000 народжених живими
- тяжкість змінюється з віком плода (важчі на ранній стадії вагітності)
– передачі стаються частіше на пізніх термінах вагітності - інфекція може призвести до: викидня, передчасних пологиів або доношених з або без прогресу захворювання
- типові прояви хвороби включають в себе: ретинохороідит, внутрішньомозкові кальцифікати, гідроцефалію, мікроцефалію, порушення психомоторних функцій, розумову відсталість, сліпоту та інші дефекти зору
Очний токсоплазмоз
Ретинохороідит, запалення сітківки і судинної оболонки (товщина судинної області в задній частині ока), є ще одним клінічним проявом інфекції токсоплазма. Ретинохороідит може виникнути в результаті вроджених інфекцій, гострих або реактивованих інфекцій, придбаних постнатально. Спочатку очні прояви були частіше пов’язані з вродженими інфекціями або пізнього прояви внаслідок реактивації вродженої інфекції. Проте, очне токсоплазмоз повідомляється зі збільшенням частоти в поєднанні з гострими інфекціями. Було висловлено припущення, що різні генотипи мають різні рівні вірулентності особливо щодо експресії очного захворювання. У разі вродженої інфекції, ретинохороідит може розвинутися у віці від декількох тижнів до року після народження. Близько двадцяти відсотків людей з вродженими інфекціями будуть проявляти ретинохороідит при народженні і в підлітковому віці 82% будуть проявляти симптоми.
Пошкодження носять вогнищевий характер і в цілому самообмежені. Вони, як вважають, є результатом кіста розриву в сітківці в реактивований випадках або тахізоітамі в гострих випадках. Клітини сітківки щодо близькі центральної нервової системи. Гранульоматозне пошкодження можуть також бути присутнім в хоріоідеї. Вогнища, як правило, двосторонній вроджених інфекцій і в односторонньому порядку, якщо він купується в післяпологовому періоді. Дослідження на тваринах свідчать про те, що некроз сітківки ока, пов’язане з ураженням обумовлено поширенням паразитів, в той час як гіперчутливість реакції на антигени toxoplasmic відповідальні за супутнього запалення. Симптоми можуть включати помутніння зору або інші візуальні дефекти. Бачення може поліпшити з дозволом запалення. Рецидиви захворювання були відзначені, але частота і фактори, що впливають на повторення не ясні. Захворювання рідко буває прогресивним у імунокомпетентних осіб, але може шрам на сітківку. Проте, хвороба може бути вельми серйозними у хворих на СНІД та продовжувати прогресувати.
Дж.Н. Голланд (2003) Очний токсоплазмоз: глобальна переоцінка: частина I: епідеміологія і перебіг хвороби. Американський журнал офтальмології 136, 973-988.
Дж.Н. Голланд (2004) Очний токсоплазмоз: глобальна переоцінка: частина II: прояви хвороби й управління нею. Американський журнал офтальмології 137, 1-17.
Діагностика, лікування та профілактика
На відміну від більшості інших протозойних інфекцій, діагностика рідко проводиться шляхом виявлення або відновлення організмів, але в значній мірі спирається на процедури серологічних. Паразити можуть бути виявлені в зразках біопсії, лейкоцитарну плівку клітини, або спинно-мозкової рідини. Проте, виявлення тахізоіти з цих матеріалів може бути ускладнене. Ці зразки також можуть бути використані для щеплених мишей або клітин для культивування тканин або аналізували за допомогою ПЦР. Результати можуть вводити в оману, хоча, так як багато людей були піддані токсоплазмозу і цист гавані тканини (брадизоіти). Тому серологічні тести рекомендується компонент діагностики.
Серологічний діагноз токсоплазми також є складним через переважання серозно-позитивних осіб. Високі титри антитіл самі по собі не є остаточними свідченням гострої інфекції. Вроджені інфекції так само важко діагностувати серологічно, оскільки материнський IgG проникає через плаценту і зберігається протягом декількох місяців. Докази гострої інфекції є високі титри антитіл класу IgM і/або значне збільшення загального титру антитіл в поєднанні з симптомами. методи візуалізації (КТ, МРТ) також може бути корисним в діагностиці токсоплазмового енцефаліту.
Показання для лікування і тривалість:
– Симптоматичних пацієнтів слід лікувати до тих пір, поки прояви вщухли, і є докази набутого імунітету.
– Пацієнти з ретинохороідитом повинні бути доповненням з кортикостероїдами для придушення запалення.
– Вагітні жінки повинні бути оброблені спіраміцину, щоб запобігти зараженню плода.
– Новонароджені повинні розглядатися протягом 12 місяців, щоб уникнути більш пізні входжень ретинохороідиту.
– У пацієнтів з імунодефіцитом повинні бути оброблені. Терапія повинна тривати протягом 4-6 тижнів після припинення симптомів, а потім всередину для профілактики тих пір, поки триває імуносупресії.
Рекомендоване лікування – синергетична комбінація піріметаміну плюс сульфадиазину добавки з фолієвою кислотою (Leucovorin®).
Прогноз гострого токсоплазмозу у імунокомпетентних дорослих відмінно. Гострі інфекції у плода або дітей молодшого віку може супроводжуватися повторюваними атаками ретинохороідиту. Лікування дійсно здається, зменшити частоту цих атак. Якщо почалася досить рано, лікування пацієнтів з ослабленим імунітетом, як правило, призводить до поліпшення, але нові спалахи є загальними.
Заходи по боротьбі з токсоплазмозу уваги уникнути двох основних джерел інфекції: сире м’ясо і забрудненими котячими фекаліями. Профілактичні заходи (вставка) включають в себе: уникати проковтування спорулірованних ооцист або тканинних кіст, руйнування заразних форм, а також профілактики інфікування домашніх тварин (наприклад, опалення.). Профілактика особливо важливо під час вагітності, коли наслідки інфекції є найбільш серйозними.
Огляди з питання токсоплазми:
- Розділ Токсоплазма гонді. Автор Дж.П. Дубі
- Тентер та інші (2000). Міжнародний журнал із паразитології 30, 1217
- Д. Хілл, Дж.П. Дубі (2002) Токсоплазма гонді: передача, діагностика та профілактика. Клінічна мікробіологія й інфекції 8:634-640.
- Д.E. Хілл, С. Чірукандота та Дж.П. Дубі (2005) Біологія й епідеміологія токсоплазми гонді в людині й тваринах. Огляди досліджень здоров’я тварин 6:41-61.
- Дж.Г. Монтоя й О. Лізенфельд (2004) Токсоплазмоз. Скальпель 363:1965-1976.
| Неоспора канінум |
|---|
| Неоспора канінум тісно пов’язана з токсоплазмою і має майже однакову морфологію. Як і з токсоплазмозом, неоспора заражає багато домашніх тварин і є однією з основних причин абортів і мертвонароджень у великої рогатої худоби по всьому світу. Остаточні господарі собак, які мають нервово-м’язових захворювань. Люди не господар. Собаки заражаються після вживання в їжу заражених тканин від проміжних господарів. неспорульовані ооцити опадають в калі і утворюють спори в навколишньому середовищі. Проміжні господарі набувають інфекцію при прийомі всередину спорулірованних ооцист. Однак, на відміну від токсоплазми, проміжні господарі не можуть придбати інфекцію при прийомі всередину форм тканин з інших проміжних господарів. Інфекція може передаватися врожденно і паразит легко зберігається у великої рогатої худоби і собак по вертикальній передачі. Лісовий цикл за участю білохвостий олень і койотів також були ідентифіковані (Роузіпал і Ліндсей, Тренди в паразитології 21, 349. 2005). |
Бабезіоз
| Історична примітка |
|---|
| У 1893 році Сміт і Кілборн повідомили, що кліщі переносять Б. бігеміна, причину лихоманки великої рогатої худоби Техасу. Це була перша демонстрація членистоногих переданого захворювання і, ймовірно, надихнуло подальше відкриття інших векторних переданих захворювань, таких як жовта лихоманка і малярія. |
Бабезіоз є рідкісною зоонозною інфекціяєю передається кліщами. Етіологічні агенти, види бабезії, паразити крові, які заражають велику різноманітність диких і домашніх тварин по всьому світу. Бабезія та тейлерія утворюють групу під назвою піроплазми, по відношенню до інтраеритроцитозних формах, грушоподібний у деяких видів. Піроплазми викликають величезні втрати худоби в ендемічних районах. Чи є припускалося, що чума великої рогатої худоби єгиптян описані в біблійній книзі Вихід, можливо, була червона вода лихоманка викликана штамом Б. бові.
Два піроплазми пологів, як правило, відрізняються відсутністю преерітроцітарная циклу в бабезії і відсутність трансовариальной передачі в тейлерії (див. життєвий цикл нижче). Молекулярні дані вказують на те, що бабезія і тейлерія види не утворюють відповідні монофілогенні групи. Зокрема, багато видів бабезії, які були неофіційно згрупованих як “невеликий” бабезія, більш тісно пов’язані з тейлерією. Відповідно до цього молекулярним даними, жоден з невеликого бабезія – на відміну від “великої” бабезія – не по-видимому, передається трансовариально в кліщах, що передбачає необхідність деякої переоцінки класифікації піроплазм. (Див. Дж. Уйленберг, 2006. Бабезія – історичний огляд. Ветеринарна паразитологія 138, 3-10.)
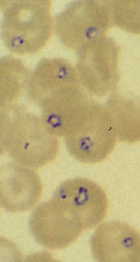
Багато видів бабезії було зареєстровано інфікувати людей. Три найбільш переважні види інфікувати людей є Б. мікроті, Б. дункані та Б. дивергенс (таблиця). Інфекції з іншими видами були або погано документовані або обмежується кількома одиничних випадках. Перші випадки захворювання були пов’язані з спленектомії або інших імунокомпетентних шкоди умовах. Проте, імуно-компетентні особи, інфіковані бабезією і не виявляють клінічних симптомів були описані. Крім серологічні дослідження дозволяють припустити, що інфекція може бути під діагноз. Найбільшу увагу людських інфекцій в США було уздовж північно-східного реберної області, що призводить до імені Нантакет лихоманки і верхньої Midwest. Інфекція в Європі, мабуть більш рідкісні, то в США, але більш зі смертельними наслідками. Більшість з цих інфекцій були пов’язані з людьми, які мають частий контакт з великої рогатої худоби.
Життєвий цикл
Бабезія демонструє типовий апікомплексні життєвий цикл характеризується мерогоніі, гаметогоніі і спорогоніі (малюнок). Інфекція купується хребетного господаря, коли спорозоїти (Sp) передаються під час годування кліща. Спорозоїти вторгнутися еритроцитами, що використовують механізм вторгнення, який схожий на інший найпростіших. (Див. детальне обговорення вторгнення клітини-господаря по малярії паразита.) На відміну від плазмодію, то паразітофорной вакуольна мембрана (PVM) розпадається після вторгнення і паразит знаходиться в безпосередньому контакті з господарем цитоплазмі еритроцитів. У трофозоїти (Tr) ділять бінарного розподілу і виробляти мерозоитов (Mz), які заражені додаткові еритроцити і відновлюємо репликативной циклу. У деяких видів, тетради, згадується як мальтійський хрест, іноді спостерігається.
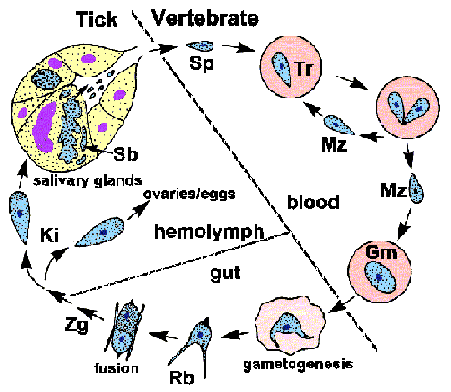
Деякі з трофозоітов перетворяться в гаметоцитов (Gm), або гамонти, які відповідальні за ініціювання інфекції в векторі кліща. Гаметоцити зазнають морфологічні зміни в кишечнику кліща і розвиваються в променевих органів (Rb; також циліарне тіло). Два променя тіла (тобто гамет) буде зливатися з утворенням зиготи (ZG), яка потім розвивається в кінету (Ki). Кінета проникає через мембрану перітрофічного і кишкового епітелію, щоб отримати доступ до гемолимфе. Велика бабезія, таке Б. дивергенс і Б. каніс, здатні до вторгнення різні органи і піддається подальшому реплікації. Найбільш помітним є вторгнення яєчників і яєць, що призводять до трансовариальної передачі потомству кліща.
Спорогоніі ініціюється, коли кінети проникають в слинні залози. Паразит розширюється і заповнює гіпертрофованої клітини-господаря і розвивається в багатоядерних споробластах (Sb; він же споронт). Зрілі спорозоїти, володіючи апікальні органели, нащадки з цього недиференційованого споробласту, коли кліщ знову харчується на нового господаря. П’ять-десять тисяч спорозоїтів може бути вироблено одним споробластом. Спорозоїти буде потім вводити в організм господаря зі слиною, таким чином, завершуючи життєвий цикл.
| Тейлерія і лімфобластогенез |
|---|
| Види тейлерія заражають і викликають захворювання у худоби, і особливо велика рогата худоба, в багатьох частинах світу. Найбільш серйозним є східне узбережжя лихоманка великої рогатої худоби, викликаних Т. парва. Він має 90-100 відсотків смертності в Африці. Т. аннулата викликає більш легкі форми хвороби великої рогатої худоби вздовж Середземного моря і на Близькому Сході, відомий як тропічний тейлеріоз. Тейлерія тісно пов’язані з бабезія і мають дуже схожий життєвий цикл (рис 16.1). Основною відмінністю є преерітроцітарная стадії виставлені видів тейлерія. Хоча така преерітроцітарная стадія підозрюється в Б. мікроті. Спорозоїти вторгнутися лімфоцити і індукують проліферацію лімфоцитів господаря за допомогою невідомого механізму. Паразит розвивається в шизонт (багатоядерних тобто меронт), який піддається розподіл, що збігається з реплікацією проліферативної лимфоцита, і, таким чином, шизонт передається кожному з дочірніх лімфоцитів. Отримані в результаті мерозоїти вражають еритроцити і в кінцевому підсумку перетворитися в гамонти, які є заразними для галочки. Це процес лімфопроліферативного, що призводить до важких проявів хвороби, пов’язані з тейлеріозом. Ця трансформація лімфоцитів є оборотним в тому, що лікування призводить до паразитувати кліренс і подальше проліферацію лімфоцитів гальмується. |
 |
 |
 |
 |
Клінічні особливості
У осіб з інтактними селезінці інфекція, як правило, самообмеження і характеризується поступовим початком нездужання, лихоманка, головний біль, озноб, пітливість, біль у м’язах, втома і слабкість. Помірний до помірної гемолітичної анемії також може супроводжувати ці симптоми. Багато інфекції буде вирішувати самостійно, без лікування, але паразити можуть зберігатися протягом декількох місяців. Захворювання має тенденцію бути більш швидкоплинний і важкого ступеня в splenectomized або імунодефіцитом осіб і можуть бути небезпечними для життя. Parasitemias з> 25% і важкої анемії може статися.
Там немає явно ефективних препаратів проти бабезіозу. Рекомендоване лікування клиндамицин + хінін. Пентамідин також було показано, придушити, але не усунути, паразітеміі. Хлорохін, хоча, схоже, не впливає на паразітеміі, дійсно забезпечує деяке полегшення симптомів, яке може бути пов’язане з його протизапальними властивостями. Атоваквон + азитроміцин було показано, бути настільки ж ефективним, як кліндаміцин + хінін, але з меншою кількістю шкідливих впливів (Краус та ін., 2000., Медичний журнал Нової Англії 343:1454). Обмінне переливання крові був використаний в якості рятувального зусилля в важких хворих.
Огляд бабезіозу:
- Ваньєр Е. і Краузе П.Дж. (2012) Бабезіоз у людини. Медичний журнал Нової Англії 366:23972407.
ПОСИЛАННЯ
- Нагору
- Найпростіші, що інфікують людей
- Походження водоростей найпростіших
- Кокцидії
– Криптоспоридії
– Ізоспора
– Циклоспора
– Діагностика та лікування
– Тканинна кіста, що формує кокцидію (саркоцистоз)
- Токсоплазмоз
– Життєвий цикл
– Клінічні особливості
– Діагностика, лікування та профілактика
- Бабезіоз
– Життєвий цикл
– Клінічні особливості
- Протозоологія. Головна сторінка
– Навчальні посібники
– Програма навчання
- Інші курси та лекції
- Уайзер. Головна сторінка
- Інші інтернет-сайти
1. Центри з контролю і профілактики захворювань
– Криптоспоридіоз
– Циклоспоріаз
– Ізоспоріаз
– Токсоплазмоз
– Бабезіоз
2. Медичний запис
3. Переклад цієї веб-сторінки болгарською мовою
4. Переклад цієї веб-сторінки угорською мовою
