Original: http://www.ks.uiuc.edu/Research/aquaporins/

Переможець Змагання з візуалізації в науці й інженерії 2004 року,
організованому Національним науковим фондом і Журналом “Наука”. (Див. відповідну статтю в журналі “Наука”.)
Наш фільм про водопроникність і Нобелівська премія в області хімії 2003 року Nobel
Мистецтво водного перенесення в аквапорінах
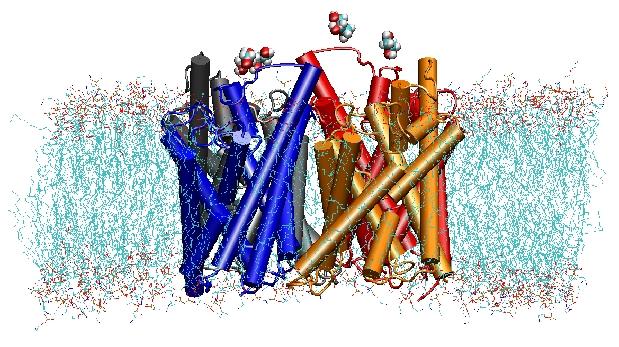
Аквапорінов мембранні водні канали, які відіграють вирішальну роль в контролі вмісту води в клітинах. Ці канали широко поширені в усьому їхньому царстві життя, в тому числі бактерій, рослин і ссавців. Більше десяти різних аквапоріни були знайдені в людському тілі, а кілька захворювань, таких як катаракта і вроджені нефрогенної нецукровий діабет, пов’язані з порушенням функції цих каналів. Вони утворюють тетрамери в клітинній мембрані, і полегшити транспортування води і, в деяких випадках, інші невеликі розчинені речовини через мембрану. Проте, пори води повністю непроникні для заряджених частинок, таких як протони, дивовижну властивість, що має вирішальне значення для збереження електрохімічного потенціалу мембрани, але парадоксально, в той же час, так як протони, як правило, можуть бути передані легко через молекули води. Результати нашого моделювання вже представили нове розуміння механізму, що лежить в основі дивовижне властивість. Молекули води, що проходять канал змушені, електростатичними силами білка, щоб перевернути в центрі каналу (див анімацію), порушуючи тим самим альтернативний механізм донорно-акцепторного, який необхідний для протонів транслокації (читати повну історію в нашій роботі “Наука”).
 Функціональне застосування своєрідної архітектури протеїнів
Функціональне застосування своєрідної архітектури протеїнів
У 2000 році Лабораторії Страуд при Каліфорнійському університеті в Сан-Франциско вдалося вирішити першу структуру з високим просторовим дозволом з аквапорінов за допомогою рентгенівської кристалографії. Досліджувана структура була однією з палички E. поглинання гліцерину сприяє (GlpF), який представляє собою аквагліцеропоріни, тобто канал також проникні для невеликих лінійних молекул цукрів, таких як гліцерин. Наносекундне моделювання молекулярної динаміки тетрамірної GlpF в гідратованому ділянці ТАТА ліпідний бішар характеризується повний шлях провідності підкладки в каналі. Аналіз взаємодії водневих зв’язків підкладки з внутрішньою частиною каналу також пояснив вперше, чому ці канали мають у своїй архітектурі дві характерні петлі, в тому числі енергетично несприятливих елементів вторинної структури, які зберігаються в родині в цілому аквапорінов (Дженсен та ін., Структура, 2001 р.).
Енергетика цукрової проніцанії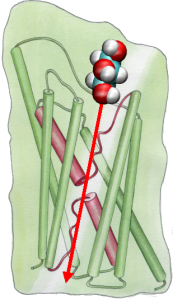
Потім ми досліджували енергетику транспортного події, щоб зрозуміти, які бар’єри субстрат необхідно подолати під час його проходження через канал. Для опису вільного енергетичного профілю, ми розрахували потенціал середньої сили для повного разі провідності з траєкторій, в яких рух гліцерину через канал був прискорений застосуванням зовнішніх сил. Цей метод, відомий як керована молекулярна динаміка (КМД), дозволяє спостерігати повільні події в доступному масштабі часу моделювання МД. Однак через нерівноважної природи траєкторій, при аналізі результатів один стикається з проблемою незворотною роботи, яка повинна скидати з рахунків. Використовуючи тотожність Jarzinsky в рівність між вільною енергією і роботою в нерівноважних системах, ми могли б повністю описати енергетику гліцерину транспорту через канал. Розрахований потенціал середньої сили захоплює основні сайти зв’язування і бар’єри в каналі в тісному порозумінні з результатами рівноважних МД і кристалічної структури. Крім того, вона показує яскраво виражену асиметрію в її формі, припускаючи, що асиметрична структура білка може бути функціонально важливим для ефективного поглинання поживних молекул з навколишнього середовища. (Дженсен та ін., Праці Національної академії наук, 2002 р.).
Що робить аквапорін гліцериновим каналом
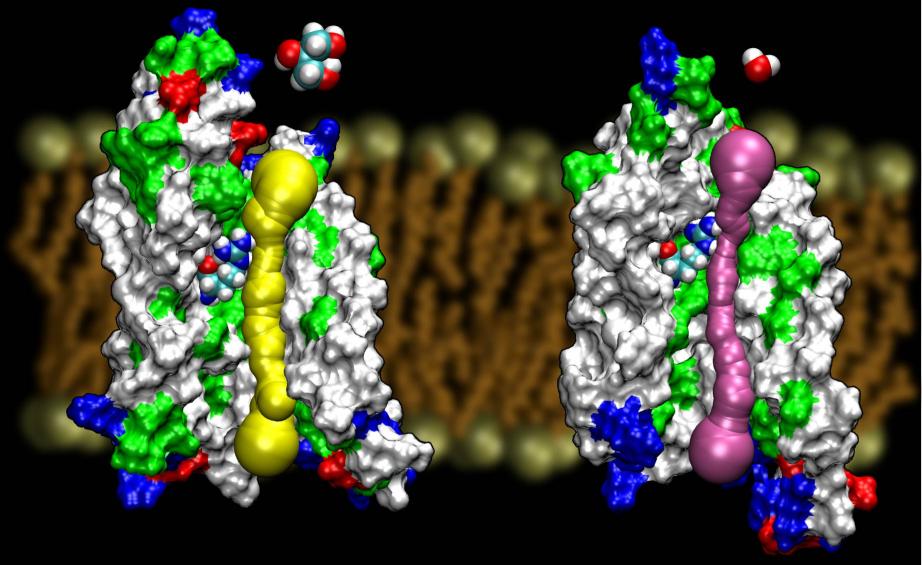
Аквапорінов є дуже везучий сімейство мембранних білків, які, як відомо, стійкі до визначення структури. Тепер ми маємо високі структури дозволу кількох AQPs: GlpF, AQP1, AQP0 і AqpZ. Інші структури, як очікується, вийти найближчим часом. Наявність структури двох AQPs з E.coli, один, що є чистої води каналу (AqpZ), а інший є гліцерином каналом (GlpF) надав нам унікальну можливість зрозуміти принципи вибірковості, використовувані за своєю природою за допомогою два генетично і структурно високо гомологични канали для мембранном різних матеріалів. Порівняння бар’єрів, розрахованих для проведення гліцерину в цих двох каналах показали, що AqpZ використовує стеріческіх бар’єрів, щоб зробити його важким для гліцерину, щоб пройти. Насправді, пор в цілому більш вузьким, ніж GlpF (дивись малюнок нижче). Здається, що природа перетворилася в дуже простий механізм, а саме настройка розміру пір каналу, для того, щоб зробити два білка з того ж сімейства мають різні властивості провідності. Прочитайте всю історію Уанг та ін., СТРУКТУРА, 2005 р.
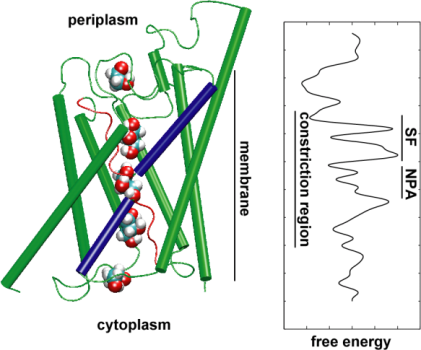
Введення каналів під тиск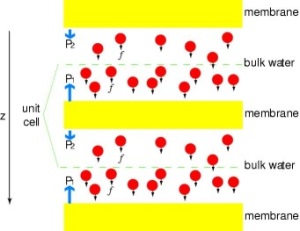
Для того, щоб безпосередньо порівняти результати моделювання з МД біохімічних вимірів провідності водних каналів мембран, в яких осмотические градієнти тиску використовуються, щоб викликати потік води через мембрану, ми розробили нову методику моделювання МД. Застосувавши малих сил на молекули води в об’ємному області (див. малюнок), гідростатичний градієнт тиску генерується через мембрану. Градієнт тиску викликає швидкості провідності, які можуть бути вивчені з МД, які, як правило, обмежується декількома наносекунд. Цей метод був застосований при моделюванні водопроникності через GlpF, і призвело до лінійної кореляції між прикладеним тиском і потоком (Жу та ін., журнал Біофіз., 2002 р.).
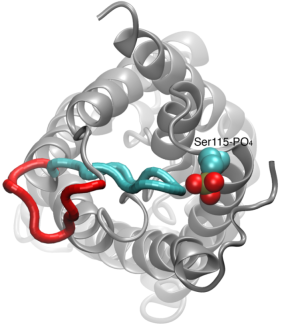 Пропускна система водних каналів
Пропускна система водних каналів
Вода проникає через аквапорінов є пасивний процес, який слід за напрямком осмотичного тиску через мембрану. Хоча багато аквапоріни функціонують як завжди відкриті канали, підгрупу аквапорінов, особливо у рослин розвинулися складні молекулярний механізм, за допомогою якого канал може бути закритий у відповідь на суворі умови навколишнього середовища, при яких обмін води може бути шкідливим для організм. Прикладами таких умов є посухи і повені, які викликають певні клітинні сигнали (дефосфорілірованіе і зміна рН), які призводять до закриття каналу. Нещодавно вирішена структура аквапорінов зі шпинату була змодельована за різних умов для дослідження молекулярної mechansim стробирования в цих мембранних каналів. Було встановлено, що подовжений цитоплазматический петля в ливникових-компетентні аквапорінов фізично закупорює вхід в парової води в замкнутому каналі і блокує доступ молекул води до пори. Зсув цього циклу в відповідь на фосфорилювання, як це спостерігалося при моделюванні, знімає петлю з цитоплазматичних входу в пори. Крім того, гідрофобний амінокислота, яка конформационно тісно пов’язаний з цією петлі буде втягнутий назад з каналу в результаті переміщення контуру. Разом ці молекулярні події призводять до відкритого каналу, який проникний молекулами води. Дослідження з’явилося у виданні “Природа” в 2006 році.
Пропускна система й іонна провідність тетрамерної пори
AQP, як правило, відомі своєю високою проникністю для води. Проте, їх участь в інших клітинних функцій, в тому числі в результаті проникнення, відмінних від води, малих молекул, а також зв’язку міжклітинної було запропоновано. Тетрамерізаціі є спільною структурною особливістю AQP. Той факт, що чотири мономери кожен утворюють функціонально незалежний парової води, але вимагають тетрамерную організації для функції, передбачає синергетичне перевага олигомеризации, і, таким чином, змушує подальший аналіз потенційної ролі центральної пори в AQP. Цікава пропозиція є можливе ураження центральної пори в іонної провідності при активації cGMP. За допомогою моделювання MD мембранних вбудованих моделей AQP1, ми досліджували це властивість AQP1, щоб визначити, яким чином і за яких конформаційних і умовах гідратації, центральний пір може проводити іони і як регулюється провідність. Одна з цитоплазматичних петель, а саме аргінін-багатий цикл D, було запропоновано нашими імітацій, щоб грати ключову роль в cGMP-опосередкованої активації центральної пори. Запропонована роль петлі D була експериментально verifired за допомогою розробленого мутанта контуру D показує повну втрату іонної провідності (Ю. та ін., Структура, 2006 р.).
Перехід молекул газу в клітини
 Щоранку, багато людей їздять на роботу, в той час як інші можуть велосипед, сісти на автобус або метро. Крім того, різні біомолекули в організмі людини також досягають свого призначення в різних манерах. Наприклад, щоб перетнути клітинну мембрану, невеликі гідрофобні молекули газу дифундувати через ліпідний бішар, в той час як молекули води проходять через аквапоріни (AQP). Цікаво відзначити, що так само, як можна змусити працювати як на автобусі і при русі, було виявлено, останнім часом, що деякі молекули газу можуть мати більш ніж один із способів через мембрану, тобто, крім дифузії через ліпіди, кисень і діоксид вуглецю може також проходити через AQP. Проте, шляхи, що ці молекули газу приймають залишаються неясними. Використання молекулярної динаміки, виконані з Бюлетенем медичного управління СВ, ми досліджували газопроникність AQP1 з двома додатковими методами (дифузія газу явного моделювання і неявні вибірки лиганда). Результати моделювання показують, що в той час як чотири мономерні пори функції AQP1 як водні канали, центральна пір AQP1 може служити в якості шляху для молекулам газу через мембрану (Уанг та ін., Журнал структурної біології, 2007 р.).
Щоранку, багато людей їздять на роботу, в той час як інші можуть велосипед, сісти на автобус або метро. Крім того, різні біомолекули в організмі людини також досягають свого призначення в різних манерах. Наприклад, щоб перетнути клітинну мембрану, невеликі гідрофобні молекули газу дифундувати через ліпідний бішар, в той час як молекули води проходять через аквапоріни (AQP). Цікаво відзначити, що так само, як можна змусити працювати як на автобусі і при русі, було виявлено, останнім часом, що деякі молекули газу можуть мати більш ніж один із способів через мембрану, тобто, крім дифузії через ліпіди, кисень і діоксид вуглецю може також проходити через AQP. Проте, шляхи, що ці молекули газу приймають залишаються неясними. Використання молекулярної динаміки, виконані з Бюлетенем медичного управління СВ, ми досліджували газопроникність AQP1 з двома додатковими методами (дифузія газу явного моделювання і неявні вибірки лиганда). Результати моделювання показують, що в той час як чотири мономерні пори функції AQP1 як водні канали, центральна пір AQP1 може служити в якості шляху для молекулам газу через мембрану (Уанг та ін., Журнал структурної біології, 2007 р.).
Перешкоди на шляху молекули
Біологічні клітини захищають їх всередину через їх клітинні мембрани, але  покладатися на імпорт поживних речовин. Вони розвивалися для цього імпортних каналів швидких провідності, які включають надійні контрольно-пропускні пункти, що відрізняють бажані і небажані з’єднання. Контрольно-пропускний пункт ставить справжній курс перешкод, що тільки Правильно з’єднайте можуть пройти швидко. Розуміння конструкції каналу утруднено через відсутність детальних експериментальних даних про динаміку поживних. В даний час найбільш детальна інформація надходить від перегляду динаміки каналу в обчислювальному відношенні, починаючи від статичних кристалографічних структур. Недавнє дослідження, досліджували, як гліцерин, малі молекули поживних необхідні деякі бактерії, проходять через контрольно-пропускні пункти, що реалізуються через гліцерин каналу GlpF. GlpF дає чотири паралельні канали, які відстежувалися за допомогою обчислювального Бюлетеня медичного управління СВ і алгоритм, який досліджує нову енергетику каналу досить швидко, щоб бути methodologicaly здійсненно на сучасних комп’ютерах. Результати показують, як фізичні характеристики гліцерину, їх здатність утворювати так звані водневі зв’язку, їх електричні дипольні моменти, їх дифузійна рухливість і їх внутрішню гнучкість зондуючого уздовж каналу (Генін та ін., Біофізичний журнал, у пресі).
покладатися на імпорт поживних речовин. Вони розвивалися для цього імпортних каналів швидких провідності, які включають надійні контрольно-пропускні пункти, що відрізняють бажані і небажані з’єднання. Контрольно-пропускний пункт ставить справжній курс перешкод, що тільки Правильно з’єднайте можуть пройти швидко. Розуміння конструкції каналу утруднено через відсутність детальних експериментальних даних про динаміку поживних. В даний час найбільш детальна інформація надходить від перегляду динаміки каналу в обчислювальному відношенні, починаючи від статичних кристалографічних структур. Недавнє дослідження, досліджували, як гліцерин, малі молекули поживних необхідні деякі бактерії, проходять через контрольно-пропускні пункти, що реалізуються через гліцерин каналу GlpF. GlpF дає чотири паралельні канали, які відстежувалися за допомогою обчислювального Бюлетеня медичного управління СВ і алгоритм, який досліджує нову енергетику каналу досить швидко, щоб бути methodologicaly здійсненно на сучасних комп’ютерах. Результати показують, як фізичні характеристики гліцерину, їх здатність утворювати так звані водневі зв’язку, їх електричні дипольні моменти, їх дифузійна рухливість і їх внутрішню гнучкість зондуючого уздовж каналу (Генін та ін., Біофізичний журнал, у пресі).
Група з вивчення аквапорінів
• Ї Уанг
• Джин Ю
