Original: http://www.biology.arizona.edu/biochemistry/tutorials/chemistry/page3.html
Полярність води
Вода має просту молекулярну структуру. Вона складається з одного атома кисню і  двох атомів водню. Кожен атом водню ковалентно пов’язаний із киснем через спільну пару електронів. Кисень також має дві нерозділені пари електронів. Таким чином, є 4 пари електронів, що оточують атом кисню, дві пари, що беруть участь у ковалентному зв’язку з воднем, і дві неподілені пари на протилежному боці атома кисню. Кисень є “електронегативним” або “дружнім до” електронів атомом у порівнянні з воднем.
двох атомів водню. Кожен атом водню ковалентно пов’язаний із киснем через спільну пару електронів. Кисень також має дві нерозділені пари електронів. Таким чином, є 4 пари електронів, що оточують атом кисню, дві пари, що беруть участь у ковалентному зв’язку з воднем, і дві неподілені пари на протилежному боці атома кисню. Кисень є “електронегативним” або “дружнім до” електронів атомом у порівнянні з воднем.
Вода – “полярна” молекула, а це означає, що існує нерівномірний розподіл електронної щільності. Вода має частковий негативний заряд (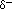 ) поблизу атома кисню через неподілену пару електронів, а також частковий позитивний заряд (Дельта-) поблизу атомів водню.
) поблизу атома кисню через неподілену пару електронів, а також частковий позитивний заряд (Дельта-) поблизу атомів водню.
Електростатичне тяжіння між парціальним позитивним зарядом поблизу атомів водню і частковим негативним зарядом поблизу кисню призводить до утворення водневого зв’язку, як показано на малюнку.
Здатність іонів та інших молекул до розчинення у воді забезпечується полярністю. Наприклад, на ілюстрації нижче хлорид натрію показаний у кристалічній формі і розчиняється у воді.
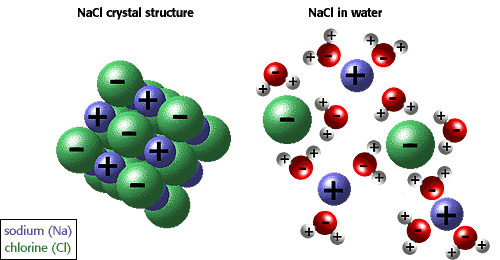
Багато інших унікальних властивостей води обумовлені водневими зв’язками. Наприклад, лід плаває, оскільки водневі зв’язки утримують молекули води більш далеко один від одного у твердому стані, ніж у рідині, де на один водневий зв’язок на молекулу менше. Унікальні фізичні властивості, у тому числі високої теплоти пароутворення, сильного поверхневого натягу, високої питомої теплоємності, і майже універсальні властивості розчинника води також надаються за рахунок утворення водневих зв’язків. Гідрофобний ефект, або виключення із з’єднань, що містять вуглець і водень (неполярні сполуки), є ще однією унікальною властивістю води, викликаною водневими зв’язками. Гідрофобний ефект особливо важливий у формуванні клітинних мембран. Кращий описати це сказавши, що вода “стискає” неполярні молекули докупи.
Кислоти та луги, іонізація води
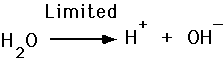
• Кислоти виділяють H+
• Луги приймають H+
Ми визначаємо рН розчину як негативний логарифм концентрації іонів водню.
• при pH 7,0 розчин нейтральний
• при більш низькому значенні рН (1-6), розчин кислий
• при більш високому рН (8-14), розчин основний
Проект "Біологія" – інтерактивний онлайн-ресурс для вивчення біології, розроблений в Університеті Арізони.
